ANEXO 1
Examen Diagnóstico
1. Indica ¿cuál de las siguientes afirmaciones permanece igual, antes y después, de una reacción química?
a. La suma de las masas molares de las sustancias involucradas
b. El número de moléculas de todas las sustancias involucradas.
c. El número de átomos de cada tipo involucrados.
d. Ambos, (a) y (c) pueden ser iguales.
e. Cada una de las respuestas de a), b) y c) pueden ser las mismas.
2. En un vaso de vidrio que contiene leche fría se forman gotas de agua en las paredes fuera del vaso (frecuentemente referido como sudor). ¿Cómo puede explicarse este fenómeno?
a. El agua de la leche se evapora y se condensa fuera de las paredes del vaso.
b. El vidrio actúa como una membrana semipermeable que permite que el agua pase a través de ella, pero no a la leche.
c. El vapor de agua del aire se condensa.
d. El frío causa que el oxígeno y el hidrógeno del aire se combinen sobre las paredes del vidrio y formen agua.
e. Todas las anteriores.
3. ¿Cuál es la masa en gramos de una solución cuando se mezclan 1 g. de sal con 20 g. de agua?
a. 19
b. 20
c. Entre 20 y 21
d. 21
e. Más de 21
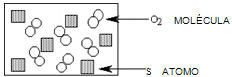
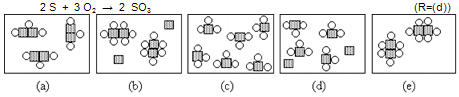
4. En el diagrama se representa una mezcla de átomos de azufre (S) y moléculas de oxígeno (O2) en un recipiente cerrado.

Indica cuál de los diagramas siguientes representa el posible resultado después que la mezcla anterior ha reaccionado completamente según la reacción:
5. Se tiene un vaso con agua y dos hielos. Después que se derriten los hielos el volumen del agua permanece igual. Este fenómeno se debe a que:
a. La masa de agua desplazada es igual a la desplazada por la masa de hielo.
b. El agua es más densa en su forma sólida (hielo).
c. Las moléculas de agua desplazan más volumen que las moléculas de hielo.
d. El agua del hielo fundido cambia el volumen del agua.
e. Cuando el hielo se funde, sus moléculas se expanden.
6. Una muestra de 1 g. de yodo sólido es colocada en un tubo. El tubo es sellado y todo el aire es evacuado. El tubo y el yodo sólido pesan 27.0 g. El tubo es calentado hasta que el yodo se evapora y se llena con yodo gaseoso. La masa en gramos después del calentamiento será:
a. Menor de 26.0
b. 26.0
c. 27.0
d. 28.0
e. Más de 28.0
7. Si a 3 g. de sal común se agrega agua hasta completar 30 g. la concentración de sal en esta solución es:
a. 1 %
b. 3 %
c. 10%
d. 30%
e. 100%
8. Si la densidad de un gas es 0.5 g/![]() ,
entonces 5.0 g. de ese gas ocuparán un volumen en
,
entonces 5.0 g. de ese gas ocuparán un volumen en ![]() de:
de:
a. 0.1
b. 0.4
c. 2.0
d. 2.5
e. 10.0
9. La fórmula del sulfato de sodio es:
a. Na2SO4
b. NaSO4
c. Na(SO4)2
d. Na2SO3
e. NaSO3
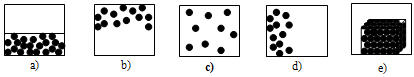
10. La figura que representa microscópicamente a un gas en equilibrio, de acuerdo con la Teoría Cinético-Molecular, es:
11. Dos moles de ácido nítrico (HNO3) contienen _____ moles de átomos de oxígeno:
a. 1
b. 2
c. 3
d. 4
e. 6
12. La relación molar de HCl/ZnCl2 en la reacción: Zn+2HCl=ZnCl2+H2 es:
a. 1:2
b. 2:1
c. 1:1
d. 2:2
e. 3:2